百科详情
发布时间:2022-03-30 16:54

目录
1基础信息
2化学式
化学式:SnCl4[2]
式量:260.50
3编号系统
 四氯化锡试剂CAS号:7646-78-8[1]
四氯化锡试剂CAS号:7646-78-8[1]
MDL号:MFCD00011242[1]
EINECS号:231-588-9[1]
RTECS号:XP8750000[1]
InChI:1S/4ClH.Sn/h4*1H;/q;;;;+4/p-4[2]
4物化性质
四氯化锡工业品为无色或淡黄色的液体,暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性,遇水分解,生成盐酸及正锡酸。[1]
遇潮湿空气,起水解反应生成锡和氯化氢,发生白烟,有腐蚀性。与计算量的水形成五水合物,白色半透明单斜晶体,在空气中潮解。溶于冷水并放出大量的热,溶于乙醇、乙醚、苯、甲苯、四氯化碳。遇热水则分解。在湿空气中吸水生成为三水物。进一步加水,生成5、8、9等不同数量的结晶水的化合物。无水氯化锡在低温下能吸收大量的氯气,同时体积形成膨胀和冰点下降;能与氨反应生成复盐;与碱金属作用生成锡酸盐。遇水强烈水解,因此在潮湿的空气中发烟;可溶于有机溶剂如乙醇、四氯化碳、苯、丙酮等。[1]
盐酸可抑制其水解作用。在19~56℃范围内,盐酸可使四氯化锡从浓溶液中以无色的水合晶体SnCl4·5H2O析出。
5计算化学数据
1、疏水参数计算参考值(XlogP):无可用
2、氢键供体数量:0
3、氢键受体数量:0
4、可旋转化学键数量:0
5、拓扑分子极性表面积(TPSA):0
6、重原子数量:5
7、表面电荷:0
8、复杂度:19.1
9、同位素原子数量:0
10、确定原子立构中心数量:0
11、不确定原子立构中心数量:0
12、确定化学键立构中心数量:0
13、不确定化学键立构中心数量:0
14、共价键单元数量:1[1]
6制备方法
①金属锡氯化法:将金属锡熔融,然后泼入冷水,激成锡花,加入反应器中,通入干燥氯气进行反应,生成四氯化锡。由于产物中有过量的游离氯而呈黄色。可加入几片锡薄片,加热蒸馏,用干燥容器接收105~120℃的馏分,制得无水氯化锡成品。其反应方程式为:
Sn+2Cl2→SnCl4
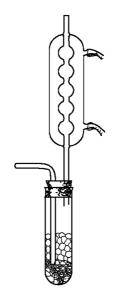 制备四氯化锡的装置
制备四氯化锡的装置
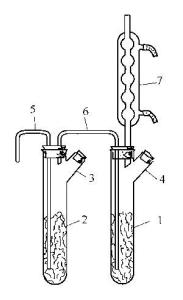 制备四氯化锡的“双联式”装置在通风橱内按图装配好仪器。大试管内装入锡粒至其体积的
制备四氯化锡的“双联式”装置在通风橱内按图装配好仪器。大试管内装入锡粒至其体积的![]() 。开始从导气管中缓慢地通入干燥的氯气,气流速度应使氯气能与锡充分反应为宜。反应很激烈,当试管底部聚集的SnCl4液层明显增厚时,适当提高导气管,但末端仍应没入溶液中。反应结束后将SnCl4倾入玻璃瓶中,加入少许锡粒用以与游离的氯作用,将此瓶密闭静置1h。蒸馏,收集112~114℃间的馏分,为防湿气侵入,接受器上应安装CaCl2干燥管。如果原料锡中含有铁,蒸馏不宜进行到底。所得SnCl4装入带玻璃塞或软木塞的玻璃瓶中。
。开始从导气管中缓慢地通入干燥的氯气,气流速度应使氯气能与锡充分反应为宜。反应很激烈,当试管底部聚集的SnCl4液层明显增厚时,适当提高导气管,但末端仍应没入溶液中。反应结束后将SnCl4倾入玻璃瓶中,加入少许锡粒用以与游离的氯作用,将此瓶密闭静置1h。蒸馏,收集112~114℃间的馏分,为防湿气侵入,接受器上应安装CaCl2干燥管。如果原料锡中含有铁,蒸馏不宜进行到底。所得SnCl4装入带玻璃塞或软木塞的玻璃瓶中。
图为制备氯化锡的装置图制备氯化锡的“双联式”装置
1,2—试管;3,4—支管;5—氯气导管;6—连接管;7—球形冷凝器
若大量制取(每天3kg)SnCl4,可采用如图的装置。当试管1中几乎充满SnCl4时,停止通氯气。在管5下面放一干燥的玻璃瓶,用橡皮球从冷凝管7上口向装置内吹气,则SnCl4被排入管5下面的玻璃瓶中。然后经支管向试管中再填装锡粒以继续反应。所接收的SnCl4的处置和提纯操作同上。产率可达90%~95%。[1]
②干燥的氯气和熔融的氯化亚锡反应可制取四氯化锡。
7主要用途
- 是制备有机锡化合物的原料,染色的媒染剂,缩合剂。
- 用作异丁烯、α-甲基苯乙烯等的阳离子聚合反应的催化剂。[1]
- 制造蓝晒纸和感光纸、润滑油添加剂,玻璃表面处理以形成导电涂层和提高抗磨性。[1]
- 用作有机合成中氯化的催化剂和糖漂白剂等;还可用于导电性涂层和镀锡。
- 氯化锡的蒸气与氨及水汽混合,生成氢氧化锡及氯化铵之微粒而呈浓烟状,军事上用以制作烟幕弹。反应式:SnCl4+4NH3+4H2O→Sn(OH)4+4NH4Cl.
- 用于制作FTO导电玻璃, FTO玻璃可以做为ITO导电玻璃的替换用品,广泛用于液晶显示屏,光催化,薄膜太阳能电池基底等方面,市场需求极大。反应式为:SnCl4+2H2O=SnO2+4HCl.
- 用作分析试剂、有机合成脱水剂。也用于电镀工业。[1]
- 醇酸酯化反应:由于酸醇醋化反应传统的生产工艺是以浓硫酸为催化剂制备, 具有生产周期长, 副产品多, 设备腐蚀严重, 反应后处理复杂, 废酸污染环境等缺点,因此人们一直致力于新型催化剂的研究, 以简化生产工艺, 降低生产成本, 四氯化锡作为高效醋化催化剂, 是一种价廉易得的化工产品, 因此, 引起人们的广泛关注, 在这方面的研究也日益增多。四氯化锡取代传统的浓硫酸催化剂作为醋化催化剂, 在酸醇醋化方面的研究最多, 研究涉及无水四氯化锡或五水四氯化锡的催化醋化、氯乙酸和醇的催化醋化、固载形式的催化醋
- 缩酮反应:王建平用SnCl4.5H2O为催化剂以环己酮、乙二醇为原料合成了环己酮缩乙二醇。
- 缩醛反应
- 双烯合成
- 脱水反应利用SnCl4.5H2O作催化剂进行脱水反应的研究不多, 尚待更进一步的研究。 四氯化锡作为典型的块固体酸催化剂之一, 在酸醇醋化、缩醛、缩酮、脱水、双烯合成、杂环合成等反应中有一定的催化作用。从人们的研究中可以看出, 四氯化锡在酸醇酯化反应中应用甚广而且重复性好, 因此有较好的应用前景。在缩醛、缩酮、脱水、双烯合成、杂环合成等反应上还有待更进一步的研究, 因此具有巨大的研究空间。
8环境影响
9健康危害
侵入途径:吸入、食入。
健康危害:对眼睛、皮肤、粘膜和呼吸道有强烈的刺激作用。吸入、摄入或经皮肤吸收对身体有害。吸入可能由于咽喉、支气管的痉挛、水肿、炎症,化学性肺炎、肺水肿而致死。中毒表现有烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐。
10毒理学资料
毒性:属低毒类。
急性毒性:LD50:99mg/kg(小鼠静注);LC50:2300mg/m3(大鼠吸入,10min)。[1]
致突变性:细胞遗传学分析:人类白细胞4mg/L。[1]
危险特性:受高热分解产生有毒的腐蚀性气体。遇氰化物能产生剧毒的氰化氢气体。
燃烧(分解)产物:氯化物。
11生态学资料
对环境有危害,应特别注意对水体的污染。[1]
12环境标准
美国(1974)职业安全及卫生管理局标准:空气:时间加权平均值2mg/m3[Sn]。
13监测方法
空气中:样品用滤器收集,再用原子吸收光谱法测定(NIOSH法)。
14应急处理
15泄漏处理
疏散泄漏污染区人员至安全区,禁止无关人员进入污染区,建议应急处理人员戴自给式呼吸器,穿化学防护服。不要直接接触泄漏物,勿使泄漏物与可燃物质(木材、纸、油等)接触,在确保安全情况下堵漏。喷水雾减慢挥发(或扩散),但不要对泄漏物或泄漏点直接喷水。将地面洒上苏打灰,然后用大量水冲洗,经稀释的洗水放入废水系统。如果大量泄漏,最好不用水处理,在技术人员指导下清除。
废弃物处置方法:废料倒在碳酸氢钠上,用氨水喷淋,同时加碎冰,反应停止后用水冲入下水道。
16防护措施
呼吸系统防护:可能接触其蒸气时,应该佩带防毒口罩。
眼睛防护:戴化学安全防护眼镜。
防护服:穿工作服(防腐材料制作)。
手防护:戴橡皮手套。
其它:工作后,淋浴更衣。单独存放被毒物污染的衣服,洗后再用。保持良好的卫生习惯。
17急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水彻底冲洗。若有灼伤,就医治疗。
眼睛接触:立即提起眼睑,用流动清水冲洗10分钟或用2%碳酸氢钠溶液冲洗。
吸入:迅速脱离现场至空气新鲜处。注意保暖,保持呼吸道通畅。必要时进行人工呼吸。就医。
食入:患者清醒时立即漱口,给饮牛奶或蛋清。立即就医。
灭火方法:砂土、二氧化碳。禁止用水。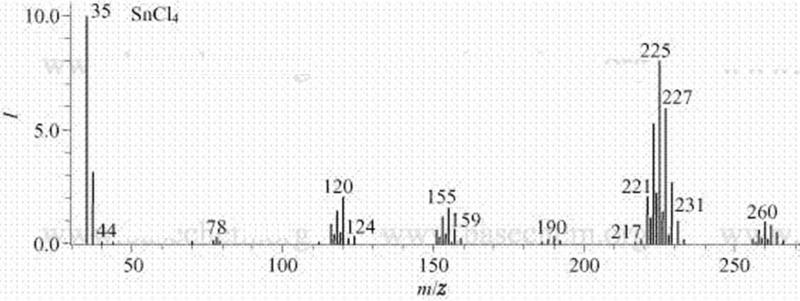 四氯化锡质谱(MS)
四氯化锡质谱(MS)
18贮存方法
储存于阴凉、干燥、通风良好的库房。远离火种、热源。库温不超过30℃,相对湿度不超过75%。包装必须密封,切勿受潮。应与易(可)燃物、碱类、醇类等分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。[1]
19安全信息
20危险运输编码
UN 1827 8/PG 2[1]
21危险品标志
腐蚀
 腐蚀
腐蚀
22安全说明
S26:万一接触眼睛,立即使用大量清水冲洗并送医诊治。
S45:出现意外或者感到不适,立刻到医生那里寻求帮助(最好带去产品容器标签)。
S61:避免排放到环境中。参考专门的说明/安全数据表。[1][3]
23危险类别码
R34:引起灼伤。
R52/53:对水生生物有害,可能在水生环境中造成长期不利影响。[1][4]
24五水合四氯化锡
CAS号:10026-06-9
25物化性质
五水合四氯化锡,白色或微黄色结晶或熔块。微有盐酸气味。吸湿性强。易溶于水,溶于乙醇。[5]
26计算化学数据
1、疏水参数计算参考值(XlogP):未确定
2、氢键供体数量:5
3、氢键受体数量:5
4、可旋转化学键数量:0
5、拓扑分子极性表面积(TPSA):5
6、重原子数量:10
7、表面电荷:0
8、复杂度:19.5
9、同位素原子数量:0
10、确定原子立构中心数量:0
11、不确定原子立构中心数量:0
12、确定化学键立构中心数量:0
13、不确定化学键立构中心数量:0
14、共价键单元数量:6[6]
27制备方法
- 由无水四氯化锡缓慢地加入到水中,得到的热溶液在搅拌下冷却结晶制得。或者将氯气通入二氯化锡溶液中至饱和,加热蒸发,再冷却结晶,分离制得。
- 向33mL水中分次少量地逐渐加入100g无水氯化锡,溶解时剧烈放热,所得透明液体在搅拌和冷却下即可全部结晶。产量100~103g,产率约85%。
- 将干燥的氯气通到装有金属锡粒的带有冷凝器的容器底部,进行反应:Sn+2Cl2=SnCl4反应比较激烈,放出的热量使四氯化锡发进入冷凝器,待反应结束后,将四氯化锡倒回反应器,密封静置1h,让过量锡与游离氯结合,然后将溶液蒸馏,收集112~114℃馏分,得无水四氯化锡。在搅拌下将所得四氯化锡溶解到适当蒸馏水中 (100g四氯化锡用33ml水) ,溶解时大量放热,待透明热溶液冷却至完全结晶,即为结晶四氯化锡。[6]